À propos
Traitement métastatique HER2+
Les médecins du Centre des maladies du sein du CHU de Québec se sont réunis pour définir les options d’investigation et de traitement issues des standards éprouvés dans la littérature. Le document qui en découle est une aide guidant notre pratique. Cependant, le jugement est toujours de mise selon les conditions médicales particulières, l’opinion du patient et l’évolution de la littérature.
La participation à un essai clinique est toujours favorisée lorsque la patiente y est éligible.
La maladie HER2 positive se définit par l’immunohistochimie (IHC) 3+ ou par un test FISH positif.
L’apparition nouvelle d’une maladie métastatique chez une patiente déjà connue pour un cancer du sein devrait être biopsiée dans la mesure du possible. L’analyse des récepteurs hormonaux et du HER-2 devrait être refaite. Cela est suggéré étant donné la possibilité :
- De détecter des métastases provenant d’une tumeur primaire autre que le sein.
- Que les métastases puissent avoir des caractéristiques différentes du cancer primaire.
Il faut s’assurer de faire une évaluation cardiaque (fraction d’éjection) par échographie cardiaque ou ventriculographie isotopique avant le traitement incluant un anti-HER2 et aux 3 mois par la suite. Cependant, si les fractions d’éjection sont toujours adéquates et que la patiente est sous trastuzumab depuis plus d’un an, il semble raisonnable d’espacer les contrôles de mesure de la fraction d’éjection aux 6 mois en l’absence de symptômes.
Face à une maladie métastatique cérébrale, il est important de discuter avec l’équipe de radio-oncologie ou en réunion multidisciplinaire de cancer du sein afin d’évaluer la possibilité d’adresser un traitement local par radiothérapie. À noter qu’il n’y a pas d’indication claire de dépister la maladie métastatique cérébrale mais le clinicien doit avoir un faible seuil pour le faire.
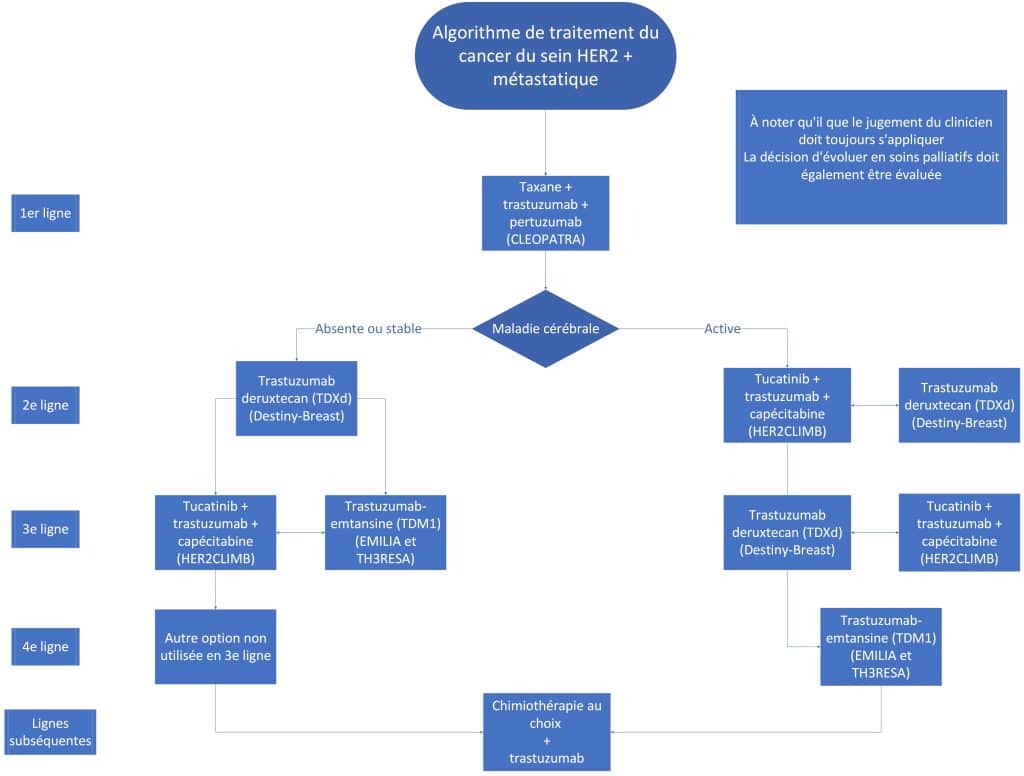
Première ligne
L’étude CLEOPATRA, ayant démontré un gain de survie globale significatif par l’ajout du pertuzumab au docétaxel et au trastuzumab, demeure encore à l’heure actuelle le standard en première ligne [1]. Le choix de la taxane à utiliser est préférablement le paclitaxel, basé sur l’étude PERUSE démontrant une survie similaire, mais un profil d’effets secondaires différent entre les options [2]. Le paclitaxel ou le nab-paclitaxel demeurent des alternatives acceptables. Le paclitaxel est administré de façon hebdomadaire et poursuivi jusqu’à progression ou polyneuropathie souvent incommodante, habituellement pour une durée moyenne de 6 mois, selon la réponse et la tolérance.
Pour les patientes répondant toujours au traitement après la cessation de la taxane, le trastuzumab et le pertuzumab sont poursuivis en entretient. Lors de la progression, il est recommandé de retenter le paclitaxel à la combinaison anti-HER2 si la patiente avait expérimenté une bonne réponse à la chimiothérapie. Sinon, une thérapie de deuxième ligne est encouragée.
Pour celles ayant progressé en 6 mois après le traitement néo-adjuvant ou adjuvant, comprenant l’utilisation de trastuzumab-emtansine (TDM1) en l’absence de réponse pathologique complète, il est recommandé de passer à la deuxième ligne métastatique. Si la progression survient après 6 mois, il est raisonnable de tenter le traitement de première ligne métastatique.
Maladie HER2 positive avec récepteurs hormonaux positifs
Le cancer avec récepteurs hormonaux (RH) positifs, est présent jusqu’à 50% des patientes avec cancer HER2 positif [3]. On peut alors le qualifier de cancer triple positif. Le pronostic de ces patientes semble meilleur que celles avec maladie HER2 positif et RH négatifs [3]. Ces patientes doivent être traitées à la fois avec une thérapie anti-HER2 et une thérapie anti-hormonale.
En première ligne avec le régime THP, la thérapie anti-hormonale est ajoutée lorsque la taxane est cessée (durant l’entretient de trastuzumab-pertuzumab, selon des avis d’experts). L’inhibiteur de l’aromatase (IA) est préférable au tamoxifène. Les femmes pré-ménopausées doivent se voir offrir la suppression ovarienne avec leur thérapie anti-hormonale. Si la chimiothérapie n’est pas administrée, on combine alors le trastuzumab avec l’inhibiteur de l’aromatase (IA).
Deuxième ligne
L’impact de la maladie métastatique cérébrale influence grandement le choix de thérapie de deuxième ligne.
Patiente avec métastases cérébrales actives
Plusieurs lignes directrices à travers le monde préconisent l’utilisation du tucatinib-capécitabine-trastuzumab chez cette population. Si l’accès le permet, cette thérapie est favorisée. L’étude HER2CLIMB incluait des patientes avec une médiane de 3 lignes antérieures pour le traitement du cancer métastatique (post trastuzumab, pertuzumab et TDM1) et comparait la place tu tucatinib ou placebo à la capécitabine et au trastuzumab [4]. Un gain de survie significatif a été observé dans la population globale : survie sans progression 7.8 vs 5.6 mois (HR 0.54) et survie globale 21.9 vs 17.4 mois (HR 0.66). Des analyses secondaires spécifiquement pour la population avec métastases cérébrales (environ 50% des patientes, dont métastases traitées et stables, métastases non traitées et ne nécessitant pas de traitement ou métastases traitées et progressant mais ne nécessitant pas de traitement) ont montré une survie presque doublée avec l’ajout du tucatinib. Pour la sous-population comprenant toutes les patientes avec métastases cérébrales, la survie sans progression était de 9.9 vs 4.2 mois (HR 0.32) et la survie globale était de 18.1 vs 12 mois (HR 0.58). Pour la sous-population avec métastases cérébrales actives, la survie sans progression était de 9.5 vs 4.1 mois (HR 0.36) et la survie globale était de 20.7 vs 12.0 mois (HR 0.49) [5]. Ce régime comporte toutefois plusieurs effets secondaires rendant la tolérance au traitement difficile.
Patiente sans métastase cérébrale ou avec métastases cérébrales stables
L’étude DESTINY-Breast03 a étudié la comparaison entre le TDXd et le TDM1 en deuxième ligne post exposition à une taxane et trastuzumab [6]. On incluait également des patientes ayant progressé 6 mois après le traitement adjuvant ou néo-adjuvant du cancer localisé ou localement avancé. Avec un taux réponse d’environ 80%, de même qu’un gain de survie sans progression de 22 mois (28.8 vs 6.8 mois, HR 0.33) et de survie globale (HR 0.64) [7]. Ces données ont fait du TDXd la deuxième ligne de traitement.
Également, l’abstract paru en 2021 de la sous-analyse de Destiny-Breast03 portant sur la sous-population avec métastases cérébrales stables (15% de la population à l’étude, pas d’inclusion de métastases cérébrales actives), a démontré un gain de survie sans progression comparé au TDM1, 15 vs 3 mois (HR 0.25) [8].
Il est important de noter toutefois qu’il n’y a pas d’étude à l’heure actuelle comparant directement le TDXd et le régime tucatinib-capécitabine-trastuzumab.
Par ailleurs, l’analyse regroupée des études Destiny-Breast 01-02-03 présenté en 2023 a démontré un taux de réponse intra-cérébral d’environ 45% avec l’utilisation du TDXd. Pour les patientes avec métastases cérébrales traitées et/ou stables, la survie sans progression était estimée à 12.3 vs 8.7 mois (HR 0.59). Pour les patientes avec métastases cérébrales actives, la survie sans progression était estimée à 18.5 vs 4.0 mois (HR 0.19), le tout analysé avec le comparateur [9]. Il s’agit donc d’une autre thérapie possible même en présence de maladie cérébrale active (basé sur l’analyse regroupée rétrospective).
Troisième ligne et lignes subséquentes
Plusieurs options existent en troisième ligne. La thérapie non-utilisée de deuxième ligne est ici recommandée. Même en l’absence de métastase cérébrale, après le TDXd, la triple thérapie tucatinib-capécitabine-trastuzumab est privilégiée selon l’étude HER2CLIMB. Sinon, le TDM1 est favorisé. L’étude EMILIA avait démontré un bénéfice à l’utilisation du TDM1 est était considéré l’ancien standard de traitement de deuxième ligne [10]. L’étude TH3RESA a elle-aussi démontré un bénéfice en troisième ligne comparé à une chimiothérapie au choix de l’investigateur [11].
En ligne subséquente, la chimiothérapie est au choix du clinicien (capécitabine, éribuline, vinorelbine, carboplatin-gemcitabine, etc.) et combinée au trastuzumab. La poursuite de l’anti-HER2 devrait toujours se faire en lignes subséquentes. Il est important de noter que les patientes avec maladie HER2 positive présentent une sensibilité aux anthracyclines. Il faut toutefois éviter de l’administrer avec le trastuzumab. Cependant, la doxorubicine liposomale peut être combinée au trastuzumab sans signe d’excès de cardiotoxicité selon quelques données de petites études [12, 13].
Si l’on fait face à une oligoprogression cérébrale en présence d’une maladie systémique stable, on tente d’adresser localement (avec radiothérapie ou chirurgie) tout en continuant le même traitement systémique.
HER2 low
Les tumeurs HER2 low sont définies par un HER2 IHC 1+ ou 2+ avec FISH négatif. L’étude DESTINY-Breast04 a étudié le TDXd comparé à la chimiothérapie au choix, en deuxième ligne métastatique ou lors de progression en 6 mois et moins d’un traitement (néo)-adjuvant pour la population HER2 low [14]. La très grande majorité était aussi RH positif. Le taux de réponse était évalué à 50%. La mise à jour de 2023 démontre une survie sans progression de 8.8 mois vs 4.2 mois (HR 0.36) et une survie globale 22.9 vs 16.8 mois (HR 0.69) pour le TDXd comparé à la chimiothérapie au choix. Le bénéfice significatif s’observait à la fois dans les cohortes RH positif et négatif. Il s’agit donc d’une autre option pour les tumeurs triples positives.
Gestion de la pneumonite induite par le TDXd
L’ESMO a publié en 2022 des lignes directrices de gestion des toxicités induites par le TDXd [15]. Parmi celles-ci, on note la pneumonite induite au TDXd. Le taux de pneumonite associé à cette molécule est rapporté dans les différentes études à environ 10%-15%. La toxicité grade 3 et plus est estimée à 2-3% [6, 16]. Il faut demeurer très vigilant dans la gestion de cette complication :
- Surveillance : interrompre TDXd si une pneumonite est suspectée
- Confirmer : tester saturation, demander un TDM thoracique haute résolution et considérer une consultation en pneumologie afin d’évaluer les diagnostiques alternes.
- Gradation selon CTCAE 5e édition
- Grade 1 : asymptomatique, découverte fortuite clinique ou radiologique. Pas d’intervention nécessaire
- Grade 2 : symptomatique (y compris la désaturation) avec présence radiologique de pneumonite. Intervention médicale nécessaire, atteinte des AVDs.
- Grade 3 : symptômes sévères, atteinte des AVQs, nécessité d’oxygène
- Grade 4 : menace à la vie
- Grade 5 : décès.
* Veillez prendre note que le guide suivant a été mis à jour en date du 14/10/2024. N’hésitez pas à consulter des sites références pour vous gardez à jour et assurer l’efficacité de vos suivis.
Ne pas reproduire sans permission
Références
- Swain SM, Baselga J, Kim SB, Ro J, Semiglazov V, Campone M, et al. Pertuzumab, trastuzumab, and docetaxel in HER2-positive metastatic breast cancer. N Engl J Med. 2015;372(8):724-34.
- Miles D, Ciruelos E, Schneeweiss A, Puglisi F, Peretz-Yablonski T, Campone M, et al. Final results from the PERUSE study of first-line pertuzumab plus trastuzumab plus a taxane for HER2-positive locally recurrent or metastatic breast cancer, with a multivariable approach to guide prognostication. Ann Oncol. 2021;32(10):1245-55.
- Ma D, Yang Q, Yin K, Shi P, Chen X, Dong T, et al. Analysis of the clinicopathological characteristics and prognosis of triple-positive breast cancer and HER2-positive breast cancer-A retrospective study. Front Oncol. 2022;12:999894.
- Murthy RK, Loi S, Okines A, Paplomata E, Hamilton E, Hurvitz SA, et al. Tucatinib, Trastuzumab, and Capecitabine for HER2-Positive Metastatic Breast Cancer. N Engl J Med. 2020;382(7):597-609.
- Lin NU, Borges V, Anders C, Murthy RK, Paplomata E, Hamilton E, et al. Intracranial Efficacy and Survival With Tucatinib Plus Trastuzumab and Capecitabine for Previously Treated HER2-Positive Breast Cancer With Brain Metastases in the HER2CLIMB Trial. J Clin Oncol. 2020;38(23):2610-9.
- Cortes J, Kim SB, Chung WP, Im SA, Park YH, Hegg R, et al. Trastuzumab Deruxtecan versus Trastuzumab Emtansine for Breast Cancer. N Engl J Med. 2022;386(12):1143-54.
- Hurvitz SA, Hegg R, Chung WP, Im SA, Jacot W, Ganju V, et al. Trastuzumab deruxtecan versus trastuzumab emtansine in patients with HER2-positive metastatic breast cancer: updated results from DESTINY-Breast03, a randomised, open-label, phase 3 trial. Lancet. 2023;401(10371):105-17.
- Hurvitz S, Kim S-B, Chung W-P, Im S-A, Park YH, Hegg R, et al. Abstract GS3-01: Trastuzumab deruxtecan (T-DXd; DS-8201a) vs. trastuzumab emtansine (T-DM1) in patients (pts) with HER2+ metastatic breast cancer (mBC): subgroup analyses from the randomized phase 3 study DESTINY-Breast03. Cancer Research. 2022;82(4_Supplement):GS3-01-GS3-.
- Hurvitz SA, Modi S, Li W, Park YH, Chung W, Kim SB, et al. 377O A pooled analysis of trastuzumab deruxtecan (T-DXd) in patients (pts) with HER2-positive (HER2+) metastatic breast cancer (mBC) with brain metastases (BMs) from DESTINY-Breast (DB) -01, -02, and -03. Annals of Oncology. 2023;34:S335-S6.
- Verma S, Miles D, Gianni L, Krop IE, Welslau M, Baselga J, et al. Trastuzumab emtansine for HER2-positive advanced breast cancer. N Engl J Med. 2012;367(19):1783-91.
- Krop IE, Kim SB, Martin AG, LoRusso PM, Ferrero JM, Badovinac-Crnjevic T, et al. Trastuzumab emtansine versus treatment of physician’s choice in patients with previously treated HER2-positive metastatic breast cancer (TH3RESA): final overall survival results from a randomised open-label phase 3 trial. Lancet Oncol. 2017;18(6):743-54.
- Rayson D, Suter TM, Jackisch C, van der Vegt S, Bermejo B, van den Bosch J, et al. Cardiac safety of adjuvant pegylated liposomal doxorubicin with concurrent trastuzumab: a randomized phase II trial. Ann Oncol. 2012;23(7):1780-8.
- Chia S, Clemons M, Martin LA, Rodgers A, Gelmon K, Pond GR, et al. Pegylated liposomal doxorubicin and trastuzumab in HER-2 overexpressing metastatic breast cancer: a multicenter phase II trial. J Clin Oncol. 2006;24(18):2773-8.
- Modi S, Jacot W, Yamashita T, Sohn J, Vidal M, Tokunaga E, et al. Trastuzumab Deruxtecan in Previously Treated HER2-Low Advanced Breast Cancer. N Engl J Med. 2022;387(1):9-20.
- Rugo HS, Bianchini G, Cortes J, Henning JW, Untch M. Optimizing treatment management of trastuzumab deruxtecan in clinical practice of breast cancer. ESMO Open. 2022;7(4):100553.
- Modi S, Saura C, Yamashita T, Park YH, Kim SB, Tamura K, et al. Trastuzumab Deruxtecan in Previously Treated HER2-Positive Breast Cancer. N Engl J Med. 2020;382(7):610-21.
Guide de pratique de la CMS – Mise à jour 3 février 2021
Ne pas reproduire sans permission
À propos
- Historique
- Mission
- Documents transfert première ligne
- Transfert MD de familles/IPS-PL
- Référence CMS – Professionnels
- Équipe interdisciplinaire
- Équipes partenaires
- Autres services
- Équipe du CMS
- Équipes partenaires
- Autres services
- Où sommes-nous ?
- Centrales de rendez-vous
- Lignes directrices
- Évènements et actualités
- F.A.Q. et réponses à vos questions

