À propos
Chimiothérapie en cancer du sein cancer triple négatif métastatique
Les médecins du Centre des maladies du sein du CHU de Québec se sont réunis pour définir les options d’investigation et de traitement issues des standards éprouvés dans la littérature. Le document qui en découle est une aide guidant notre pratique. Cependant, le jugement est toujours de mise selon les conditions médicales particulières, l’opinion du patient et l’évolution de la littérature.
La participation à un essai clinique est encouragée lorsque la patiente y est éligible.
La définition du statut triple négatif désigne les cancers qui ont une expression des récepteurs hormonaux < 1% par IHC et qui sont HER2 0 ou 1+ en IHC ou 2+ avec FISH négatif. Cependant, l’ASCO et CAP reconnaissent maintenant une nouvelle catégorie de patientes avec récepteurs hormonaux faiblement positifs avec une positivité de 1-10% [1, 2]. Selon la présentation clinique, la prise en charge de certaines de ces patientes, notamment celles avec métastases viscérales, pourrait s’inspirer de celle des triples négatives.
Il est recommandé, pour les patientes ayant eu un cancer du sein localisé et qui présentent une récidive métastatique, de répéter de préférence une biopsie pour tester à nouveau les RH et le HER2 [3].
- Discordance entre primaire et maladie métastatique 13% pour ER, 28% pour PR et 5% pour HER2 [4]
Il faut aussi rechercher, pour toutes les patientes :
- PD-L1 selon CPS sur un spécimen pathologique (métastase ou primaire)
- Mutation germinale BRCA1et BRCA2
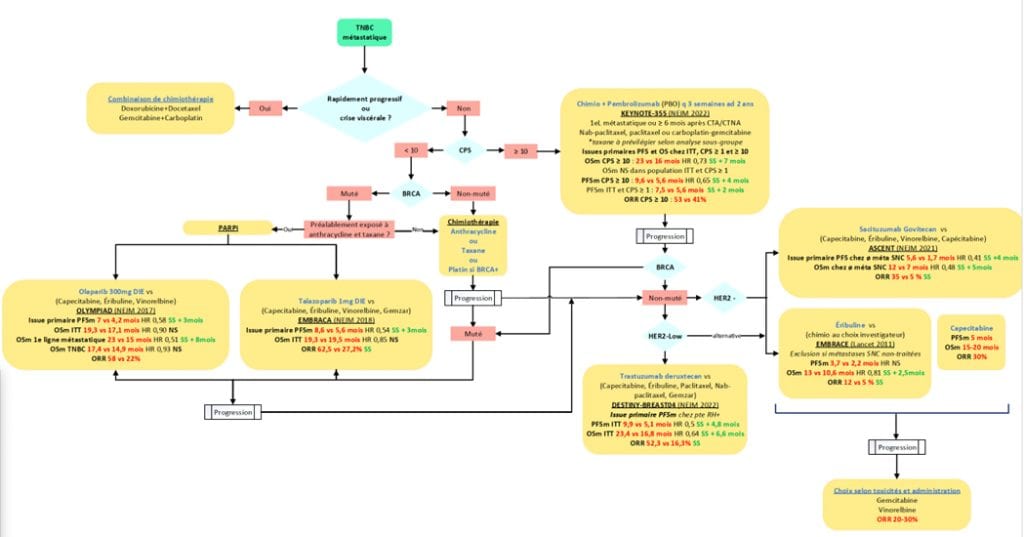
Le traitement est choisi en fonction du score PD-L1CPS (< 10 ou ≥ 10), du statut BRCA germinale et de l’atteinte viscérale (crise viscérale ou non) [5, 6].
BRCA non-muté et PD-L1/CPS < 10
Chez les patientes avec CPS < 10, l’utilisation d’une mono-chimiothérapie est favorisée, à moins qu’il y ait une crise viscérale où une combinaison pourrait être envisagée [7]. Le choix du traitement est guidé par les traitements antérieurs reçus, et le profil de toxicité. L’utilisation d’une taxane, de préférence, ou d’une anthracycline sont des choix raisonnables de première ligne à condition que leur exposition antérieure date de plus de 12 mois. L’anthracycline de choix pourrait être la doxorubicine liposomale pegylée en raison de son meilleur profil de toxicité [8]. Chez les patientes n’ayant jamais été exposées à une anthracycline, l’épirubicine ou l’adriamycine sont également des options de première ligne. Par rapport à la sélection d’une taxane, les données les comparant sont limitées. Le choix est principalement basé sur le schéma d’administration et le profil de toxicité. À noter qu’il semble y avoir un avantage de survie avec l’utilisation du docetaxel en comparaison au paclitaxel aux trois semaines, mais à un prix de toxicités plus importante et qui ne reflète pas l’utilisation standard hebdomadaire de paclitaxel [9, 10]. Voici les thérapies proposées :
- Paclitaxel 80 mg/m2 hebdomadaire, en général 3 semaines sur 4
- Doxorubicine liposomale pegylée 40 mg/m2 q 4 semaines
- Épirubicine 75 mg/m2 IV J1 q 3 semaines ou doxorubicine 60mg/m2 IV J1 +/- Cyclophosphamide 600 mg/m2 J1 q 3 semaines
- Docétaxel 75 mg/m2 q 3 semaines
- Nab-Paclitaxel 100 mg/m2 J1, 8, 15 q 21 jours (si intolérance paclitaxel)
- Capécitabine 1000 à 1250mg/m2 BID 14 jours/21 (pour cas sélectionnées)
- *Si récidive précoce (< 6-12 mois) après taxane-anthracycline adjuvant, envisager Carboplatin AUC 5 +/- Gemcitabine 1000 mg/m2 J1 et 8 q 21 jours
Crise viscérale
Si une patiente présente une atteinte viscérale importante avec compromis vital (situation d’exception) une combinaison d’agents pourrait être favoriser pour obtenir un meilleur taux de réponse et de survie sans progression, mais aucun bénéfice de survie globale n’a été démontré [11, 12]. Des évidences de qualité faible-modérée montrent un petit bénéfice de survie avec l’utilisation d’un régime à base de platin en comparaison à ceux sans platin [13]. Régimes qui pourraient représenter des options lors de situation avec crise viscérale.
- Doxurubicine 50mg/m2 + Docétaxel 75mg/m2 q 3 semaines [14]
- Gemcitabine 1000mg/m2 J1, 8 + Carboplatin AUC5 J1 q 3 semaines
- Taxol hebdomadaire (dose diminuée selon fonction hépatique)
BRCA non-muté et CPS ≥ 10
Pour les patientes avec un score PD-L1 CPS ≥ 10, le traitement de choix est la combinaison entre une taxane ou Carboplatin-Gemcitabine et pembrolizumab (KEYNOTE-355) [15]. Cependant, les analyses de sous-groupes semblent favoriser la combinaison avec la taxane. Voici les 3 combinaisons possibles :
- Pembrolizumab 200mg IV q 3 semaines + Paclitaxel 90mg/m2 J1 ,8 ,15 q 28 jours
- Pembrolizumab 200mg IV q 3 semaines + Nab-paclitaxel 100mg/m2 J1, 8, 15 q 28 jours
- Pembrolizumab 200mg IV q 3 semaines + Gemcitabine 1000mg/m2 et Carboplatin AUC 2 J1, 8 q 21 jours
Selon l’INESS, pour être éligible à cette thérapie, la patiente doit avoir une maladie métastatique de novo ou une récidive plus de 6 mois suivant la fin du traitement néoadjuvant ou adjuvant avec un anticorps ciblant le PD-1 ou le PD-L1[31]. Pour une récidive < de 6 mois; le cas devrait être discuté en CDTC à savoir si le même régime (Carboplatin- Gemcitabine – Pembrolizumab) pourrait être suggéré. Des études ont également été effectuées avec la combinaison atézolizumab et une taxane (IMpassion 130 et 131), mais vu l’absence de bénéfice de survie sans progression et de survie globale avec Taxol, son approbation a été retirée [16-18].
BRCA muté
Les patientes sans exposition préalable à la chimiothérapie qui ont un PD-L1 CPS ≥ à 10 sont éligibles à la combinaison chimiothérapie-immunothérapie décrite ci-haut [15].
Pour celles avec un score < 10, une chimiothérapie à base de platin pourrait aussi être une option initiale versus une taxane (tel que décrit section BRCA non muté) étant donné le meilleur taux de réponse et la plus longue survie sans progression dans ce sous-groupe [19]. Cependant, aucun bénéfice de survie global n’a été démontré avec le « cross-over ».
- Carboplatin AUC 6 J1q 3 semaines ou
- Carboplatin AUC 4 J1 + Gemcitabine 1000mg/m2 J1 et J8 q 3 semaines
Chez les patientes avec mutation BRCA germinale qui ont déjà été exposées l’utilisation d’inhibiteur du PARP est associée à une augmentation de la survie sans progression, mais pas de la survie globale dans deux études randomisées de phase III (OlympiAD [20] et EMBRACA [21]). Il n’y avait cependant pas de platin dans le bras comparatif de chimiothérapie.
- Olaparib 300 mg PO BID (indication reconnue par Santé Canada, non évaluée par l’INESSS pour cette indication, non inscrit aux listes des médicaments au Québec), mais programme d’accès.
Talazoparib 1 mg PO DIE (indication reconnue par Santé Canada, non évaluée par l’INESSS pour cette indication, non inscrit aux listes des médicaments au Québec). Pas de programme d’accès.
Résistance aux taxanes et anthracyclines
Il n’y a aucun standard de traitement établi à la progression après avoir été traité avec une taxane et une anthracycline. La meilleure séquence de traitement demeure inconnue.
L’utilisation du sacituzumab-govitecan (ASCENT), un anticorps conjugué contre le TROP-2 couplé au SN-38, et l’utilisation d’eribuline (EMBRACE) ont tous deux démontré un bénéfice de survie globale en comparaison à la chimiothérapie standard en troisième ligne et plus de traitement [22, 23]. Par contre, selon une deuxième étude de phase III, la capécitabine est comparable à l’éribuline et pourrait être privilégiée d’abord [24]. Par la suite, le choix de la thérapie est basé sur les toxicités attendues et le schéma d’administration. À noter que l’utilisation d’un platin en monothérapie n’est pas recommandé à moins d’être en présence d’une mutation du BRCA [19]. L’ASCO et l’ESMO recommandent l’utilisation du sacituzumab-govitecan de préférence si l’accès le permet [5, 7, 25]. Selon l’INESS, pour être éligible à ce traitement, les patientes doivent avoir au minimum deux traitements systémiques dont un pour le traitement de la maladie métastatique ou localement avancée, incluant une taxane. De plus, si une des lignes est un traitement en contexte néoadjuvant ou adjuvant, la récidive métastatique doit être survenue pendant le traitement ou à l’intérieur des 12 mois suivant sa fin [32].
- Sacituzumab-govitecan 10 mg/kg J1, 8 IV q 21 jours
- Éribuline 1.4 mg/m2 J1, 8 IV q 21 jours
- Capécitabine 1000 à 1250 mg/m2 PO BID J1 à 14 q 21 jours
- Vinorelbine 30 mg/m2 J1, 8 IV q 21 jours
- Gemcitabine 1000 mg/m2 J1, 8, 15 IV q 4 semaines
HER2-LOW
Les patientes avec un statut HER2-low définit par une positivité 1-2+ en IHC avec un FISH négatif sont éligibles à un traitement anti-HER2 qui procure un bénéfice de survie globale significatif dans une étude (DESTINY-Breast04)[26, 27]. Les patientes TN représentait une minorité des patientes dans l’étude.
- Trastuzumab Deruxtecan 5,4mg/kg IV q 3 semaines
Selon l’INESS, pour être éligibles au trastuzumab deruxtecan, les patientes doivent être atteintes d’un cancer du sein inopérable ou métastatique à faible expression de HER2 et avoir reçu au moins une chimiothérapie pour une maladie métastatique ou avoir présenté une récidive pendant une chimiothérapie adjuvante ou dans les 6 mois suivant la fin de ce traitement [32].
De façon générale le SG serait utilisé avent le TDXD (TN-HER low) mais la meilleure séquence demeure discutable.
Métastases osseuses
Ne pas oublier que les patients avec métastases osseuses, symptomatiques ou non, bénéficient de l’utilisation d’un inhibiteur des ostéoclastes. Effectivement, les études ont démontré que l’utilisation de l’acide zolendronique ou du dénosumab était associée à une réduction des évènements osseux telles les fractures, la nécessité d’une chirurgie ou de radiothérapie, la compression médullaire et l’hypercalcémie paranéoplasique [28, 29]. Concernant la fréquence d’administration, une posologie aux 4 semaines semblent être équivalente à une aux 12 semaines selon une méta-analyse [30], bien que certains experts préfèrent débuter de manière mensuelle et espacer les doses après quelques mois de traitement.
- Acide zolendronique 4mg IV q 4 semaines ou q 12 semaines
- Denosumab 120mg s/c q 4 semaines
* Veillez prendre note que le guide suivant a été mis à jour en date du 03/02/2021. N’hésitez pas à consulter des sites références pour vous gardez à jour et assurer l’efficacité de vos suivis.
Ne pas reproduire sans permission.
1. Allison, K.H., et al., Estrogen and Progesterone Receptor Testing in Breast Cancer: ASCO/CAP Guideline Update. Journal of Clinical Oncology, 2020. 38(12): p. 1346-1366.
2. Cardoso, F., et al., 5th ESO-ESMO international consensus guidelines for advanced breast cancer (ABC 5). Annals of Oncology, 2020. 31(12): p. 1623-1649.
3. Amir, E. and M. Clemons, Should a biopsy be recommended to confirm metastatic disease in women with breast cancer? The Lancet Oncology, 2009. 10(10): p. 933-935.
4. Amir, E., et al., Tissue confirmation of disease recurrence in breast cancer patients: Pooled analysis of multi-centre, multi-disciplinary prospective studies. Cancer Treatment Reviews, 2012. 38(6): p. 708-714.
5. Gennari, A., et al., ESMO Clinical Practice Guideline for the diagnosis, staging and treatment of patients with metastatic breast cancer. Annals of Oncology, 2021. 32(12): p. 1475-1495.
6. Network, N.C.C. NCCN Clinical Practice Guidelines in Oncology – Breast Cancer V2. 2024. . 2024; 256].
7. Al Sukhun, S., et al., Systemic Treatment of Patients With Metastatic Breast Cancer: ASCO Resource–Stratified Guideline. JCO Global Oncology, 2024(10).
8. O’Brien, M.E.R., et al., Reduced cardiotoxicity and comparable efficacy in a phase IIItrial of pegylated liposomal doxorubicin HCl(CAELYX™/Doxil®) versus conventional doxorubicin forfirst-line treatment of metastatic breast cancer. Annals of Oncology, 2004. 15(3): p. 440-449.
9. Jones, S.E., et al., Randomized Phase III Study of Docetaxel Compared With Paclitaxel in Metastatic Breast Cancer. Journal of Clinical Oncology, 2005. 23(24): p. 5542-5551.
10. Mauri, D., et al., Overall survival benefit for weekly vs. three-weekly taxanes regimens in advanced breast cancer: A meta-analysis. Cancer Treatment Reviews, 2010. 36(1): p. 69-74.
11. Sledge, G.W., et al., Phase III Trial of Doxorubicin, Paclitaxel, and the Combination of Doxorubicin and Paclitaxel as Front-Line Chemotherapy for Metastatic Breast Cancer: An Intergroup Trial (E1193). Journal of Clinical Oncology, 2003. 21(4): p. 588-592.
12. Piccart-Gebhart, M.J., et al., Taxanes Alone or in Combination With Anthracyclines As First-Line Therapy of Patients With Metastatic Breast Cancer. Journal of Clinical Oncology, 2008. 26(12): p. 1980-1986.
13. Egger, S.J., et al., Platinum-containing regimens for triple-negative metastatic breast cancer. Cochrane Database of Systematic Reviews, 2020. 2020(12).
14. Cassier, P.A., et al., A phase-III trial of doxorubicin and docetaxel versus doxorubicin and paclitaxel in metastatic breast cancer: results of the ERASME 3 study. Breast Cancer Research and Treatment, 2008. 109(2): p. 343-350.
15. Cortes, J., et al., Pembrolizumab plus Chemotherapy in Advanced Triple-Negative Breast Cancer. New England Journal of Medicine, 2022. 387(3): p. 217-226.
16. Emens, L.A., et al., First-line atezolizumab plus nab-paclitaxel for unresectable, locally advanced, or metastatic triple-negative breast cancer: IMpassion130 final overall survival analysis. Annals of Oncology, 2021. 32(8): p. 983-993.
17. Schmid, P., et al., Atezolizumab and Nab-Paclitaxel in Advanced Triple-Negative Breast Cancer. New England Journal of Medicine, 2018. 379(22): p. 2108-2121.
18. Miles, D., et al., Primary results from IMpassion131, a double-blind, placebo-controlled, randomised phase III trial of first-line paclitaxel with or without atezolizumab for unresectable locally advanced/metastatic triple-negative breast cancer. Annals of Oncology, 2021. 32(8): p. 994-1004.
19. Tutt, A., et al., Carboplatin in BRCA1/2-mutated and triple-negative breast cancer BRCAness subgroups: the TNT Trial. Nature Medicine, 2018. 24(5): p. 628-637.
20. Robson, M., et al., Olaparib for Metastatic Breast Cancer in Patients with a Germline <i>BRCA</i> Mutation. New England Journal of Medicine, 2017. 377(6): p. 523-533.
21. Litton, J.K., et al., Talazoparib in Patients with Advanced Breast Cancer and a Germline <i>BRCA</i> Mutation. New England Journal of Medicine, 2018. 379(8): p. 753-763.
22. Bardia, A., et al., Sacituzumab Govitecan in Metastatic Triple-Negative Breast Cancer. New England Journal of Medicine, 2021. 384(16): p. 1529-1541.
23. Cortes, J., et al., Eribulin monotherapy versus treatment of physician’s choice in patients with metastatic breast cancer (EMBRACE): a phase 3 open-label randomised study. The Lancet, 2011. 377(9769): p. 914-923.
24. Kaufman, P.A., et al., Phase III Open-Label Randomized Study of Eribulin Mesylate Versus Capecitabine in Patients With Locally Advanced or Metastatic Breast Cancer Previously Treated With an Anthracycline and a Taxane. Journal of Clinical Oncology, 2015. 33(6): p. 594-601.
25. Moy, B., et al., Chemotherapy and Targeted Therapy for Patients With Human Epidermal Growth Factor Receptor 2–Negative Metastatic Breast Cancer That is Either Endocrine-Pretreated or Hormone Receptor–Negative: ASCO Guideline Update. Journal of Clinical Oncology, 2021. 39(35): p. 3938-3958.
26. Modi, S., et al., Trastuzumab Deruxtecan in Previously Treated HER2-Low Advanced Breast Cancer. New England Journal of Medicine, 2022. 387(1): p. 9-20.
27. Moy, B., R.B. Rumble, and L.A. Carey, Chemotherapy and Targeted Therapy for Human Epidermal Growth Factor Receptor 2–Negative Metastatic Breast Cancer That Is Either Endocrine-Pretreated or Hormone Receptor–Negative: ASCO Guideline Rapid Recommendation Update. Journal of Clinical Oncology, 2022. 40(26): p. 3088-3090.
28. Stopeck, A.T., et al., Denosumab Compared With Zoledronic Acid for the Treatment of Bone Metastases in Patients With Advanced Breast Cancer: A Randomized, Double-Blind Study. Journal of Clinical Oncology, 2010. 28(35): p. 5132-5139.
29. Kohno, N., et al., Zoledronic Acid Significantly Reduces Skeletal Complications Compared With Placebo in Japanese Women With Bone Metastases From Breast Cancer: A Randomized, Placebo-Controlled Trial. Journal of Clinical Oncology, 2005. 23(15): p. 3314-3321.
30. Van Poznak, C., et al., Role of Bone-Modifying Agents in Metastatic Breast Cancer: An American Society of Clinical Oncology–Cancer Care Ontario Focused Guideline Update. Journal of Clinical Oncology, 2017. 35(35): p. 3978-3986.
31. https://inesss.algorithmes-onco.info/fr/algorithme10-consultation-version21#signet1842
À propos
- Historique
- Mission
- Documents transfert première ligne
- Transfert MD de familles/IPS-PL
- Référence CMS – Professionnels
- Équipe interdisciplinaire
- Équipes partenaires
- Autres services
- Équipe du CMS
- Équipes partenaires
- Autres services
- Où sommes-nous ?
- Centrales de rendez-vous
- Lignes directrices
- Évènements et actualités
- F.A.Q. et réponses à vos questions

