À propos
Approche de l’aisselle en cancer du sein.
L’approche de l’aisselle dans le cancer du sein évolue rapidement. Les médecins du Centre des maladies du Sein ont révisé la littérature et établi leur ligne de conduite. Le document actuel se veut un guide pour notre pratique. Cependant, le jugement est toujours de mise selon les conditions médicales particulières ou l’opinion du patient.
Ces guides sont mis à jour régulièrement.
La participation à un essai clinique est toujours favorisée lorsque la patiente y est éligible.
Investigation de l’aisselle
L’échographie de l’aisselle doit faire partie de l’investigation radiologique des patientes pour des densités ou masses mammaires suspectes. Ainsi, en présence de tout ganglion suspect, une biopsie de ce ganglion sera faite avec mise en place d’un clip. Ce clip doit être visible par échographie à court mais aussi à long terme après sa mise en place (au moins 8 mois), car il y a parfois nécessité d’une chimiothérapie néoadjuvante.
L’usage de la résonance magnétique n’est pas fait de routine.
Carcinome infiltrant – ganglion sentinelle en chirurgie initiale.
Chez les patientes sans atteinte ganglionnaire clinique ou pathologique, avec des tumeurs opérables, sans signe clinique autre, la recherche du ganglion sentinelle dans l’évaluation de l’aisselle est une technique appropriée, sécuritaire et efficace. Cependant, si les patientes présentent des contre-indications au ganglion sentinelle, tels : ulcération de la peau, érythème, infiltration de la peau ou de la paroi thoracique, peau d’orange ou œdème de la peau, la dissection axillaire est recommandée.
Il n’y a pas d’évidence de niveau 1 pour l’application de la technique du ganglion sentinelle chez les patientes présentant des antécédents de prothèse mammaire, de réduction mammaire et de maladie multicentrique. Cependant, notre groupe de chirurgiens oncologues considère qu’il est raisonnable d’effectuer cette technique chez ces patientes. Pour les patientes avec antécédents de radiothérapie sur le sein et présentant une récidive de cancer au sein, l’application de la technique du ganglion sentinelle repose sur le jugement clinique du chirurgien et sur la discussion faite avec le patient.
Ganglion sentinelle négatif (N0 et N0i+) en chirurgie initiale
En l’absence d’atteinte néoplasique (N0) ou en présence de cellules isolées (N0i+) seulement, dans un ou dans plusieurs ganglions sentinelles, les recommandations de la littérature et des chirurgiens-oncologues du Centre des Maladies du Sein est d’omettre la dissection axillaire.
Ganglion sentinelle positif (N1mic et N1) en chirurgie initiale
Antérieurement, les recommandations en présence d’atteinte métastatique (N1mic ou N1) au niveau du ganglion sentinelle étaient de procéder à la dissection axillaire.
Maintenant, suite à la publication des études ACOSOG Z0011 [1], IBCG 23-01 [2] et AMAROS [3], il y a eu remise en question de l’utilisation de façon statutaire de la dissection axillaire en présence d’atteinte ganglionnaire au niveau du ganglion sentinelle chez les patientes sans atteinte ganglionnaire palpable au diagnostic.
L’étude ACOSOG ZOO11 a semé la voie en démontrant l’absence de différence de survie, de récidive locale ou régionale lorsqu’il y a omission de dissection axillaire en présence de 1 ou 2 ganglions sentinelles étaient atteints chez des patientes soumis à une mastectomie partielle et radiothérapie. L’étude de l’IBCG 23-01 [2] supporte les données de l’ACOSOG Z0011 [1] pour les patientes avec des micrométastases.
L’étude AMAROS [3] a amené des données supplémentaires nous permettant d’omettre la dissection axillaire chez certaines autres patientes. Elle se distingue cependant de l’ACOSOG Z0011 [1]. Les patientes n’ayant pas de dissection axillaire recevaient de la radiothérapie au niveau de l’aisselle. Les mastectomies totales étaient permises (17% à 18 % des cas). Il n’y avait pas de nombre limite de ganglions sentinelles positifs. Cependant, moins de 5% des patientes de l’étude avaient 3 ganglions ou plus positifs. Les cancers multicentriques étaient permis et par le fait même les mastectomies totales. De plus, cette étude ne prenait pas en compte la présence de dépassement extra-capsulaire.
L’étude de l’IBCG 23-01 [2] supporte aussi l’omission de la dissection axillaire chez les patientes avec micrométastase au niveau du ganglion sentinelle. Dans cette étude, 9% des patientes ont eu une mastectomie totale et les patientes ne devaient pas recevoir de radiothérapie.
La prise de décision d’omettre une dissection axillaire doit être multidisciplinaire, particulièrement avec la radiothérapie.
Selon ces études, il est tout à fait adéquat d’omettre la dissection axillaire si toutes les conditions suivantes sont rencontrées :
- Cancer invasif, T1, T2 et N0 clinique
- Une radiothérapie adjuvante sera reçue (exception possible micrométastase avec mastectomie totale)
- 1-2 ganglions sentinelles positifs sans atteinte extra-capsulaire significative (un dépassement extracapsulaire de 2 mm ou moins est accepté selon la littérature [4]).
Dans un contexte adjuvant, l’examen extemporané des ganglions sentinelles ne se fait plus de routine. Elle est limitée au cas où l’aspect macroscopique du ganglion nous mènerait à considérer une dissection axillaire si ce ganglion se révèle positif.
Certaines patientes auront une biopsie d’un ganglion positif avec mise en place d’un clip, mais le traitement néoadjuvant ne sera pas retenu. Les médecins du CMS considèrent qu’il est raisonnable de procéder à une technique du ganglion sentinelle avec en plus prélèvement du ganglion clipé (aussi appelée dissection axillaire ciblée) s’il n’y a pas de ganglion suspect cliniquement palpable. A la réception du résultat de pathologie par la suite, ces cas seront abordés en considérant les études ACOSOG Z0011 [1] et AMAROS [3] s’il y a moins de 3 ganglions atteints.
Carcinome canalaire in situ et ganglion sentinelle
Chez les patientes diagnostiquées avec un carcinome canalaire in situ, il n’y a aucune indication ou recommandation de procéder à une dissection axillaire.
La littérature et les médecins du Centre des maladies du sein supportent l’utilisation du ganglion sentinelle dans certaines situations. Il est recommandé de procéder à la technique du ganglion sentinelle lors d’une mastectomie totale faite dans un contexte de carcinome canalaire in situ ou encore lorsqu’une procédure oncoplastique extensive compromettrait la recherche d’un ganglion sentinelle lors d’une seconde chirurgie. En présence d’échec de la technique, il n’est pas indiqué et recommandé de procéder à la dissection axillaire lors de cette chirurgie.
Certains éléments de la littérature suggèrent de procéder d’emblée à la technique du ganglion sentinelle pour certaines patientes chez qui le risque de retrouver un carcinome invasif est élevé à la pathologie finale (masse palpable, CCIS haut grade et comédo nécrose). Sauf exception, les médecins du Centre des maladies du sein recommandent de procéder à la chirurgie conservatrice du sein et d’attendre la pathologie finale avant de procéder à la technique du ganglion sentinelle.
Ganglion sentinelle et traitement néoadjuvant – patiente sans atteinte clinique ou pathologique pré-traitement
Ganglion sentinelle avant la chimiothérapie :
Il est encouragé de faire un bon examen clinique et échographique de l’aisselle. En présence d’un ganglion suspect radiologiquement, il est recommandé d’effectuer une biopsie et de mettre en place un clip. Il n’est plus recommandé de faire un ganglion sentinelle en prétraitement. Si un ganglion sentinelle est fait en prétraitement systémique et qu’il est positif, les patientes devront avoir une dissection axillaire au moment de la chirurgie finale.
Ganglion sentinelle après la chimiothérapie néoadjuvante :
Une méta-analyse publiée en 2016 [5] supporte l’utilisation du ganglion sentinelle chez les patientes sans atteinte ganglionnaire pré-chimiothérapie néoadjuvante. Le seuil pour procéder à une dissection axillaire doit être bas.
Les médecins du Centre des maladies du sein recommandent une dissection axillaire si le ou les ganglions sentinelles reviennent positifs après une thérapie néoadjuvante.
En présence de macrométastases, micrométastases, et cellules isolées, les ganglions sont considérés positifs. Dans ce contexte, il est essentiel que le pathologiste effectue une analyse par immunohistochimie afin de détecter les cellules tumorales isolées.
Ganglion sentinelle et traitement néoadjuvant – patiente avec atteinte clinique et/ou pathologique pré-traitement
Il est de plus en plus recommandé dans la littérature d’utiliser la chimiothérapie néoadjuvante pour convertir une aisselle positive en aisselle négative (c’est-à-dire de convertir un ganglion positif en ganglion négatif) et ainsi éviter de faire une dissection axillaire. Toutefois la première indication de chimiothérapie néoadjuvante est une indication de chimiothérapie adjuvante. Une chimiothérapie néoadjuvante ne devrait pas être utilisée s’il peut y avoir un doute sur la pertinence de donner ce même traitement en adjuvant. De plus, certaines tumeurs répondent peu au traitement systémique (par exemple, lobulaire, grade I). Ces patientes devraient avoir une chirurgie incluant la dissection axillaire si le ganglion est palpable. Si un ganglion est non-palpable mais positif à la biopsie, il peut être acceptable de procéder à une technique de dissection axillaire ciblée. Dans ce cas la dissection axillaire peut être omise si les critères de l’ACOSOG Z0011 sont rencontrés. Le traitement systémique sera ensuite choisi en fonction de la pathologie finale.
En raison des taux de réponse pathologique complète élevés (40% à 50% pour certains types de tumeur) et de la morbidité de la dissection axillaire, le monde médical s’est questionné sur la pertinence de procéder à un ganglion sentinelle à la suite d’un traitement néoadjuvant.
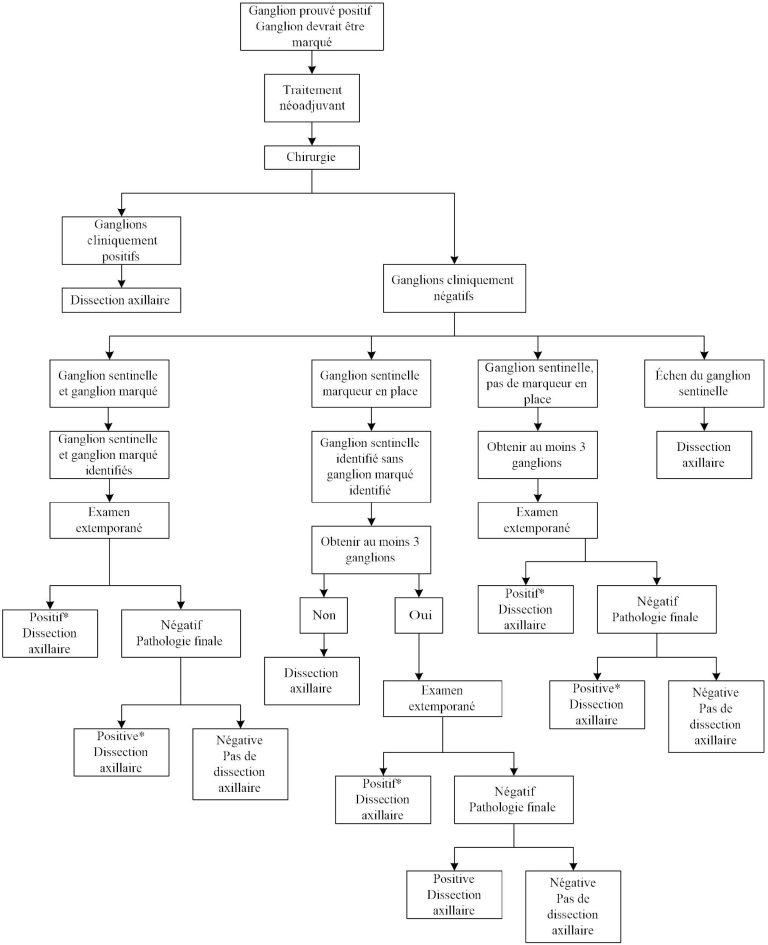
Des études ont été faites sur la faisabilité de la technique du ganglion sentinelle après des traitements néoadjuvants chez des patientes avec atteinte ganglionnaire avant le traitement (palpable ou non). Le but premier de l’étude ACOSOG Z1071 [6] (Alliance) et de l’étude SN FNAC [7] (T0 à T3) est de déterminer le taux de faux négatif d’un ganglion sentinelle après chimiothérapie néoadjuvante chez des patientes avec ganglion positif à la biopsie. Le taux de faux négatif de l’étude SN FNAC [7] est de 8,4% et celui de l’étude Alliance est de 12,6% lors de l’identification de 2 ganglions ou plus. Le seuil acceptable du taux de faux négatif est de 10%. Malgré les données favorables de l’étude SN FNAC, l’absence de données sur la survie ne permettait pas en 2013 aux médecins du Centre des maladies du sein de faire une recommandation favorable pour le ganglion sentinelle chez les patientes avec ganglion positif pré-traitement et chimiothérapie néoadjuvante. Cependant, les données contemporaines nous permettent aujourd’hui de faire un ganglion sentinelle et ainsi d’omettre la dissection axillaire chez ces patientes, pourvu qu’il y ait absence de toute maladie résiduelle axillaire pathologique après le traitement néoadjuvant. Ainsi, l’évaluation clinique de l’aisselle est importante en pré-opératoire. Si le ganglion initialement palpable est toujours suspect cliniquement (palpable) après la chimiothérapie néoadjuvante, la dissection axillaire devrait d’emblée être effectuée.
Dans le but d’abaisser au minimum le taux le faux négatif, quelques études ont été menées. La technique de la dissection axillaire ciblée a permis d’abaisser ce taux à près de 2%. Elle consiste à pratiquer la technique du ganglion sentinelle (idéalement avec bleu et isotope radioactif) en plus de recueillir le ganglion initialement positif, préalablement clipé. Ce ganglion est identifié en préopératoire à l’aide d’un harpon ou d’un grain d’iode radioactif et son excision est suivie d’un rayon X du spécimen confirmant la présence du clip. Pour que la dissection axillaire soit évitée, il faut retrouver à la fois un ou plusieurs sentinelles et aussi le ganglion clipé, et tous doivent être négatifs. Le ganglion clipé pouvant aussi être sentinelle, il se peut donc qu’un seul ganglion soit recueilli, en autant qu’il soit à la fois sentinelle et clipé.
Actuellement, au CMS, toute patiente avec ganglion axillaire initialement suspect aura une biopsie et mise en place d’un clip. Selon la pathologie, il y aura décision de chimiothérapie ou chirurgie en premier. Si une chimiothérapie est donnée en néoadjuvant, il y a examen clinique de la patiente tout au long du traitement. Si le ganglion est négatif à l’examen clinique préopératoire, la patiente est considérée pour une technique de dissection axillaire ciblée. Un examen extemporané est donc fait en peropératoire et en présence de maladie ganglionnaire, une dissection axillaire est pratiquée.
Si la congélation per opératoire est négative, le chirurgien doit attendre la pathologie finale avant de décider si une dissection axillaire est indiquée.
Dans le contexte malheureux où il n’y aurait pas eu de clip mis en place, il devient essentiel d’utiliser le double traceur (bleu et isotope) et d’obtenir au moins 3 ganglions sentinelles, tous pathologiquement négatifs, pour minimiser le taux de faux négatif et ainsi omettre la dissection axillaire.
Si le ganglion clipé ne peut être localisé par harpon ou grain d’iode en préopératoire, un rayon X des ganglions sentinelles peut être fait à la recherche du clip. Si aucun clip n’est retrouvé, il devient alors nécessaire de recueillir au moins 3 ganglions sentinelles, tous négatifs, pour omettre la dissection axillaire.
Technique du ganglion sentinelle
Après révision de la littérature et pour diminuer les douleurs associées à l’injection péri tumorale du produit radioactif, les médecins du Centre des maladies du sein et les radionucléistes ont retenu l’injection intradermique à la jonction cutanéo-aréolaire. Il s’agit d’une injection de 2 mCi de soufre colloïdal filtré, fixé sur du Tc99m, dilué dans un volume de 0,3 cc. Cette injection s’effectue le matin de la chirurgie. Exceptionnellement, l’injection s’effectue la veille. L’injection est toujours intradermique. Au Centre des maladies du sein, la lymphoscintigraphie n’est pas effectuée.
La recherche du ganglion sentinelle par l’injection de coloration bleue seule n’est pas recommandée par les médecins du Centre des maladies du sein.
Pour obtenir un meilleur taux d’identification et diminuer le taux de faux négatif, la combinaison de radioisotope et de coloration bleue est idéale. Avec leur expérience, les chirurgiens du Centre des maladies du sein jugent qu’il peut être raisonnable d’omettre l’injection de la coloration bleue si l’identification du hot spot est significatif. Le volume retenu pour l’injection de la coloration bleue est de 2,5 ml en péri tumorale ou rétromammelonnaire. Une attente de 5 minutes est faite avant le premier coup de bistouri. Les chirurgiens du Centre des maladies du sein ne recommandent plus le massage du site d’injection durant ce 5 minutes d’attente.
Les ganglions sentinelles correspondent aux ganglions qui ont une activité radioactive, qui sont bleus (si injection de la coloration bleue) ou qui sont palpables (ferme et suspect). L’activité radioactive de l’aisselle doit être inférieure ou égale à 10% du ganglion sentinelle ayant l’activité la plus élevée.
Lorsqu’une patiente a reçu une chimiothérapie néoadjuvante, le standard est d’effectuer un ganglion sentinelle avec double traçage (tc99 ET bleu) pour diminuer le taux de faux négatifs et avoir une technique fiable.
En présence d’un échec du ganglion sentinelle dans un contexte de cancer invasif, les chirurgiens du Centre des maladies du sein recommandent de procéder à une dissection axillaire de niveau I et II. De rares exceptions peuvent survenir en présence de très petites tumeurs particulièrement chez les patientes plus âgées. Le jugement clinique a donc sa place.
L’évaluation pathologique per opératoire du ganglion sentinelle n’est pas fait de façon systématique pour les patientes. Les chirurgiens du Centre des maladies du sein ont une approche individualisée selon la pathologie, les comorbidités de la patiente et le traitement de chaque patiente.
Figure 1. Algorithme pour la dissection axillaire pour une tumeur T1-T2 et cN0 en chirurgie initiale
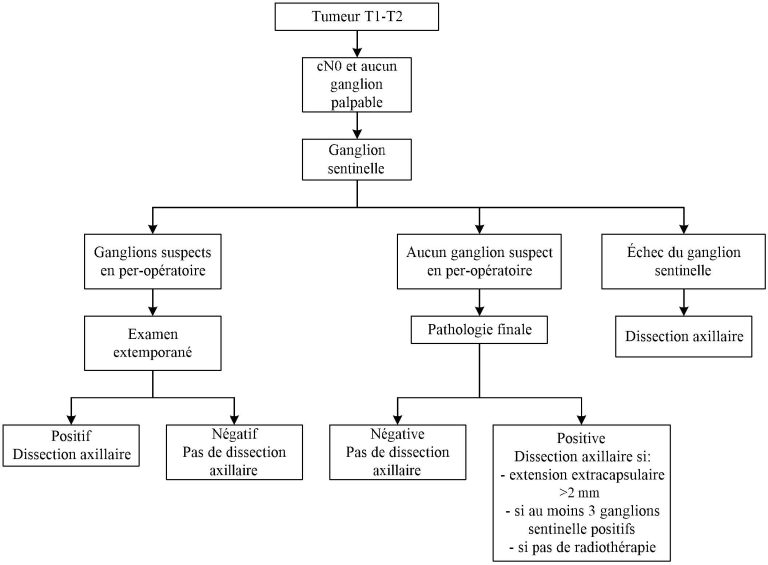
Figure 2. Algorithme pour la dissection axillaire pour une tumeur T3-T4 et cN0 en chirurgie initiale
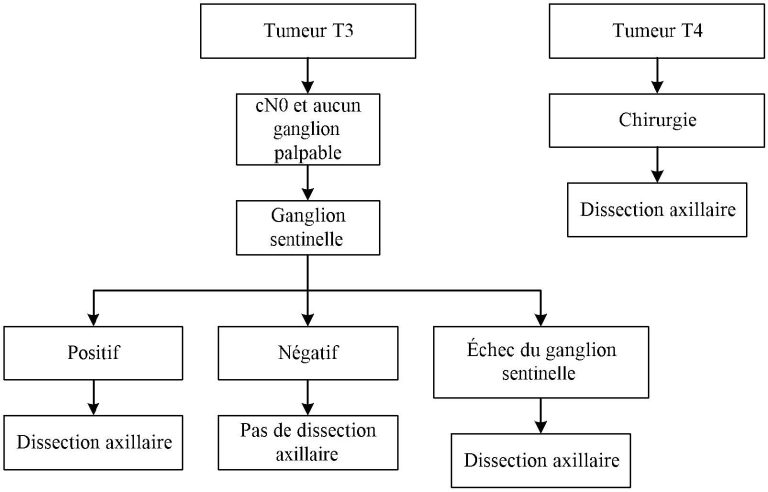
Figure 3. Algorithme pour la dissection axillaire pour une tumeur T1-T2 et N+ en chirurgie initiale
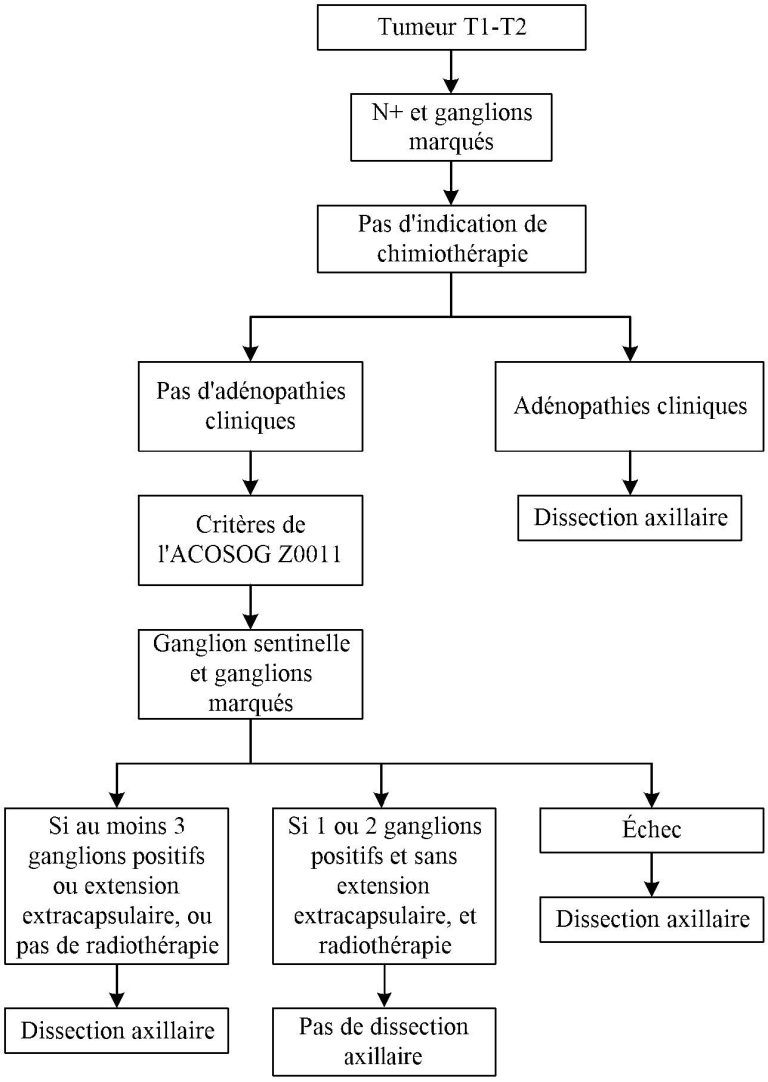
Figure 4. Algorithme pour la dissection axillaire en contexte néoadjuvant et cN0
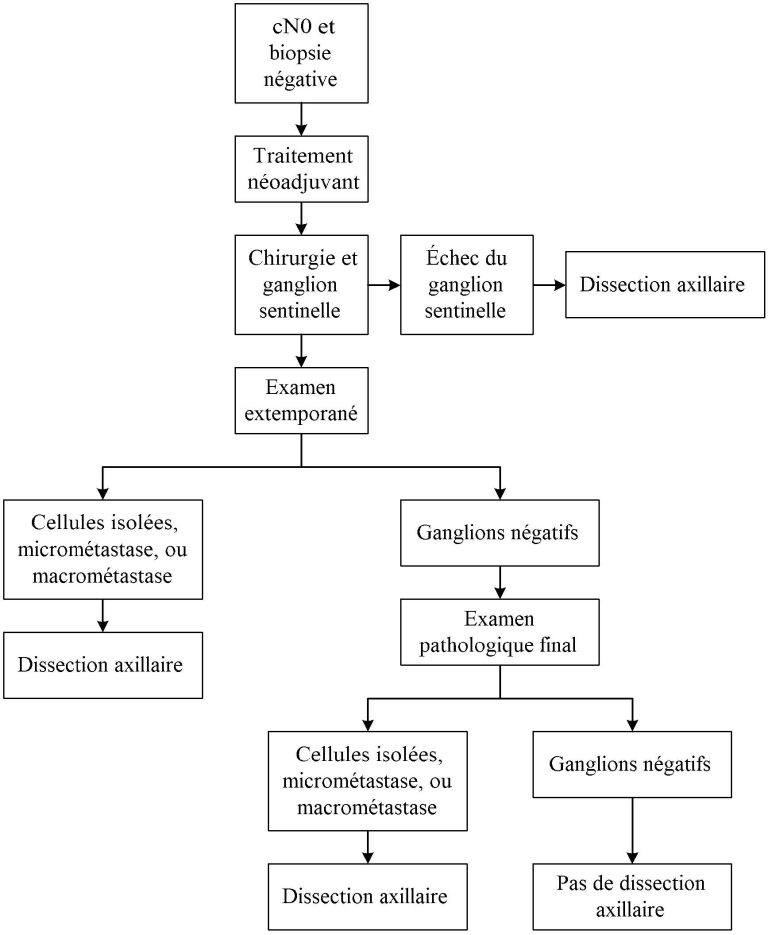
Figure 5. Algorithme pour la dissection axillaire en contexte néoadjuvant et N+. *Inclus cellules isolées, micrométastases, et macrométastases.
* Veillez prendre note que le guide suivant a été mis à jour en date du 04/03/2021. N’hésitez pas à consulter des sites références pour vous gardez à jour et assurer l’efficacité de vos suivis.
Ne pas reproduire sans permission.
- Giuliano AE, Hunt KK, Ballman KV, Beitsch PD, Whitworth PW, Blumencranz PW, et al. Axillary dissection vs no axillary dissection in women with invasive breast cancer and sentinel node metastasis: a randomized clinical trial. JAMA. 2011;305(6):569-75. Epub 2011/02/10. doi: 10.1001/jama.2011.90. PubMed PMID: 21304082; PubMed Central PMCID: PMCPMC5389857.
- Galimberti V, Cole BF, Zurrida S, Viale G, Luini A, Veronesi P, et al. Axillary dissection versus no axillary dissection in patients with sentinel-node micrometastases (IBCSG 23-01): a phase 3 randomised controlled trial. Lancet Oncol. 2013;14(4):297-305. Epub 2013/03/16. doi: 10.1016/S1470-2045(13)70035-4. PubMed PMID: 23491275; PubMed Central PMCID: PMCPMC3935346.
- Donker M, van Tienhoven G, Straver ME, Meijnen P, van de Velde CJ, Mansel RE, et al. Radiotherapy or surgery of the axilla after a positive sentinel node in breast cancer (EORTC 10981-22023 AMAROS): a randomised, multicentre, open-label, phase 3 non-inferiority trial. Lancet Oncol. 2014;15(12):1303-10. Epub 2014/12/03. doi: 10.1016/S1470-2045(14)70460-7. PubMed PMID: 25439688; PubMed Central PMCID: PMCPMC4291166.
- Gooch J, King TA, Eaton A, Dengel L, Stempel M, Corben AD, et al. The extent of extracapsular extension may influence the need for axillary lymph node dissection in patients with T1-T2 breast cancer. Ann Surg Oncol. 2014;21(9):2897-903. Epub 2014/04/30. doi: 10.1245/s10434-014-3752-0. PubMed PMID: 24777858; PubMed Central PMCID: PMCPMC4346337.
- Geng C, Chen X, Pan X, Li J. The Feasibility and Accuracy of Sentinel Lymph Node Biopsy in Initially Clinically Node-Negative Breast Cancer after Neoadjuvant Chemotherapy: A Systematic Review and Meta-Analysis. PLoS One. 2016;11(9):e0162605. Epub 2016/09/09. doi: 10.1371/journal.pone.0162605. PubMed PMID: 27606623; PubMed Central PMCID: PMCPMC5015960.
- Boughey JC, Suman VJ, Mittendorf EA, Ahrendt GM, Wilke LG, Taback B, et al. Sentinel lymph node surgery after neoadjuvant chemotherapy in patients with node-positive breast cancer: the ACOSOG Z1071 (Alliance) clinical trial. JAMA. 2013;310(14):1455-61. Epub 2013/10/09. doi: 10.1001/jama.2013.278932. PubMed PMID: 24101169; PubMed Central PMCID: PMCPMC4075763.
- Boileau JF, Poirier B, Basik M, Holloway CM, Gaboury L, Sideris L, et al. Sentinel node biopsy after neoadjuvant chemotherapy in biopsy-proven node-positive breast cancer: the SN FNAC study. J Clin Oncol. 2015;33(3):258-64. Epub 2014/12/03. doi: 10.1200/JCO.2014.55.7827. PubMed PMID: 25452445.
À propos

